新聞網訊 阿爾茨海默病(Alzheimer’s Disease��,AD���,老年性癡呆)是最主要的神經退行性疾病�����,其發病機制尚未闡明�,臨床更缺少有效的治療手段�����。近日����,中央民族大學生命與環境科學學院程金波副教授在AD致病機制方面取得了重要進展��,研究成果以“Microglial Calhm2 regulates neuroinflammation and contributes to Alzheimer’s disease pathology”為題于2021年8月25日在線發表在國際頂級期刊Science子刊Science Advances(影響因子14.1,醫學1區Top)上。文章鏈接:https://advances.sciencemag.org/content/7/35/eabe3600�。

β-淀粉樣蛋白(β-Amyloid,Aβ)的過度沉積和Tau蛋白的過度磷酸化是AD重要的病理特征,被認為是造成神經損傷的重要原因���,同時這些過程均與鈣穩態密切相關,因而逐漸形成了AD的鈣穩態假說���。該假說認為Aβ可以引起神經細胞鈣內流,從而產生過多的活性氧�,最終造成神經細胞死亡���,然而目前鈣穩態在小膠質細胞激活以及神經炎癥中的作用尚不清楚����。
近年來����,鈣穩態調節蛋白在AD中的作用受到越來越多的關注,其中鈣穩態調節蛋白Calhm2的蛋白結構已被解析(Nature, 2019)�����,但其在體的生理功能尚不清楚�。在本研究中,發現鈣穩態調節蛋白Calhm2在臨床AD患者以及AD動物模型小鼠中顯著上升����;進一步利用Calhm2全身敲除小鼠(Calhm2 KO)�、神經元條件性Calhm2敲除小鼠(Calhm2flox/flox;CamKIIα-iCre)����、小膠質細胞條件性Calhm2敲除小鼠(Calhm2flox/flox:Cx3cr1-CreER)�����,結合AD動物模型 (5×FAD),明確了小膠質細胞中Calhm2缺失顯著降低小鼠腦內Aβ沉積以及神經炎癥水平�,顯著改善AD模型小鼠的認知障礙����;通過微量基因組學、細胞膜離子通道檢測、鈣信號檢測�、免疫組織化學等方法��,發現Calhm2敲除顯著降低了小膠質細胞的炎癥激活能力,增加了其吞噬能力;這一過程與Calhm2調控小膠質細胞內的鈣內流以及P2X7的功能密切相關(下圖)���。
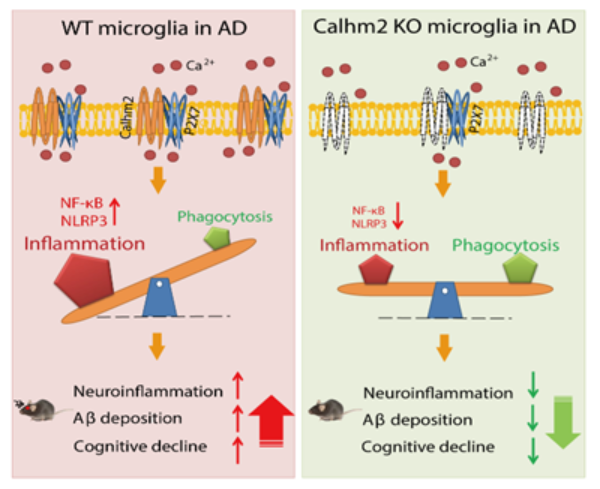
本研究明確了Calhm2在小膠質細胞激活中的重要作用,豐富和拓展了AD領域中的鈣穩態理論,進一步揭示了神經炎癥發生的分子機制����,為靶向神經炎癥治療AD提供了重要靶點和潛在的干預策略����。同時,本研究中建立的技術體系和研究方法,為深入研究AD的致病機制以及干預提供了前提和保障。
程金波是本論文第一作者和通訊作者�,青島大學董淵博士為共同第一作者���,學校特聘教授��、軍事醫學研究院袁增強研究員為共同通訊作者。本項工作得到上海交通大學于燁教授、中國科學院微生物研究所王亮博士的大力幫助���,得到國家自然科學基金重點項目以及面上項目等項目的聯合資助。
程金波一直從事神經系統疾病的致病機制與干預研究,前期開展的研究已發現小膠質細胞在神經炎癥發生以及神經系統疾病中發揮重要作用(Autophagy, 2020,影響因子16.0�;Cell Death and Differentiation, 2017,影響因子15.8����;Journal of Neuroinflammation,2020, 2021,影響因子8.3)��。
2019年9月,程金波作為優秀人才從軍事醫學研究院進入我校生命與環境科學學院任教。任教以后,先后獲得國家自然科學基金面上項目��、軍隊重大項目子課題等項目�。